Las disoluciones, también conocidas como soluciones, son mezclas homogéneas. El componente principal se llama solvente, y los componentes menores se llaman soluto. Si ambos componentes en una solución son 50%, el término soluto puede asignarse a cualquiera de los componentes. Cuando el gas o material sólido se disuelve en un líquido, el gas o material sólido se llama soluto. Cuando dos líquidos se disuelven entre sí, el componente principal se llama solvente y el componente menor se llama soluto.
Muchas reacciones químicas se llevan a cabo en disoluciones, y también están estrechamente relacionadas con nuestra vida cotidiana. El aire que respiramos, los líquidos que bebemos y los fluidos en nuestro cuerpo son todas soluciones. Además, estamos rodeados de soluciones como el aire y las aguas en ríos, lagos y océanos.
Para disoluciones con componentes en la misma fase, las sustancias presentes en menor concentración son solutos, mientras que la sustancia presente en mayor abundancia es el solvente. Usando el aire como ejemplo, los gases de oxígeno y dióxido de carbono son solutos, mientras que el gas nitrógeno es el solvente.
Vamos a comparar el azúcar en agua. El azúcar se disuelve y se extiende por todo el vaso de agua. La arena se hunde hasta el fondo. El agua de azúcar es una mezcla homogénea, mientras que el agua de arena es una mezcla heterogénea. Ambas son mezclas, pero solo el agua azucarada también se puede llamar una solución.
Las disoluciones pueden ser sólidos disueltos en líquidos. Cuando trabajas con química o incluso cocinas, generalmente disolverás sólidos en líquidos. Las soluciones también pueden ser gases disueltos en líquidos, como agua carbonatada. También puede haber gases en otros gases y líquidos en líquidos. Si mezcla cosas y se mantienen en una distribución uniforme, es una solución.
Probablemente no encontrará personas haciendo disoluciones sólidas. Por lo general, comienzan como soluciones sólidas / gaseosas / líquido y luego se endurecen a temperatura ambiente. Las aleaciones con todo tipo de metales son buenos ejemplos de disoluciones sólidas a temperatura ambiente.
A continuación, definiremos en detalle lo que son las disoluciones, cómo se clasifican, cuáles son sus características, relación con otras ramas y mucho más. ¡Acompáñanos!

¿Qué son las disoluciones?
Antes de sumergirnos en las disoluciones, separemos las soluciones de otros tipos de mezclas. Las disoluciones son grupos de moléculas que se mezclan y se distribuyen uniformemente en un sistema. Los científicos dicen que las disoluciones son sistemas homogéneos. Todo en una solución se distribuye uniformemente y se mezcla a fondo. Las mezclas heterogéneas tienen un poco más de una cosa (mayor concentración) en una parte del sistema en comparación con otra.
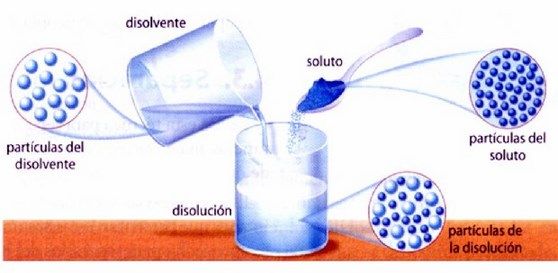
Una disolución se define como mezclas homogéneas de dos o más sustancias. A menudo, un componente de una solución está presente en una concentración significativamente mayor, en cuyo caso se llama solvente. El otro componente de la solución presente en concentraciones relativamente menores se llama soluto.
Por mayor y menor nos referimos a cualquier componente que tenga la mayor presencia en masa o en moles. A veces esto se vuelve confuso, especialmente con sustancias con masas molares muy diferentes.
Por lo general, las personas piensan que es un líquido con un sólido o un líquido o un gas disuelto en él. Sin embargo, esto no es del todo cierto. También podemos tener soluciones sólidas como aleaciones. Por ejemplo:
- Aire: es una mezcla de gas en gas. El aire es una mezcla homogénea de varios gases. Los dos componentes principales de los gases son oxígeno (21%) y nitrógeno (78%)
- Aleaciones: las aleaciones son mezclas homogéneas de metales. No se pueden separar en sus componentes individuales por métodos físicos. Independientemente de eso, una aleación se considera una mezcla. Esto se debe a que una aleación muestra las propiedades de sus componentes y puede tener una composición variable. Por ejemplo, el latón es una mezcla de 30% de zinc y 70% de cobre.
Componentes de una disolución
Las sustancias que forman una disolución homogénea se denominan componentes de la solución. Básicamente tiene dos componentes, es decir, un solvente y un soluto.
Solvente
 El componente de una disolución que disuelve el otro componente en sí mismo se llama solvente. Un disolvente constituye el componente más grande de la solución. Por ejemplo, una solución de azúcar en agua es sólida en el líquido. Aquí, el azúcar es el soluto y el agua es el solvente.
El componente de una disolución que disuelve el otro componente en sí mismo se llama solvente. Un disolvente constituye el componente más grande de la solución. Por ejemplo, una solución de azúcar en agua es sólida en el líquido. Aquí, el azúcar es el soluto y el agua es el solvente.
Soluto
El componente de la disolución que se disuelve en el solvente se llama soluto. El soluto es el componente más pequeño de la disolución. Por ejemplo, una solución de yodo en alcohol conocida como ‘tintura de yodo’, el yodo es el soluto. Del mismo modo, en las bebidas carbonatadas (agua de soda), el gas dióxido de carbono es el soluto.
Factores que afectan la disolución
Para que un soluto sea disoluble en un solvente particular, se deben considerar tres cosas. Primero, las fuerzas intermoleculares que mantienen unidas las moléculas del disolvente deben romperse para dejar espacio al soluto. Esto requiere energía, es decir, la ruptura de enlaces siempre requiere energía. En segundo lugar, las fuerzas intermoleculares que mantienen unido el soluto deben romperse.
De nuevo, esto requiere energía. Finalmente, el soluto y el solvente pueden interactuar a través de las fuerzas disponibles. Esto libera energía, la formación de enlaces emite energía, y se llama energía de solvatación.
Si la energía necesaria en los primeros dos pasos no es demasiado grande y la energía de solvatación es suficientemente grande, la energía total será negativa o ligeramente positiva, se formará una disolución. La naturaleza más aleatoria o desordenada de una disolución proporciona un impulso adicional si la energía es un poco positiva. La regla «lo similar se disuelve como» se refiere al hecho de que si las fuerzas intermoleculares en el solvente y el soluto son similares, las interacciones soluto / solvente probablemente también sean similares.
Características de la disolución
- Son homogéneos. Es decir, después de mezclar una solución, tiene la misma composición en todos los puntos.
- El estado físico de una disolución, ya sea sólido, líquido o gaseoso, es típicamente el mismo que el del solvente.
- Los componentes de una disolución se dispersan a escala molecular. Es decir, consisten en una mezcla de moléculas separadas, átomos y/o iones.
- El soluto disuelto en una disolución no se sedimentará ni se separará del solvente. La composición de una solución, o las concentraciones de sus componentes, pueden variarse continuamente, dentro de ciertos límites.
- Las partículas de una disolución pasan a través del papel de filtro. Por lo tanto, la filtración no puede separar la solución.
- Es muy estable. Las partículas de soluto presentes en una solución no se separan al guardarlas.
- Una disolución verdadera no dispersa la luz, porque sus partículas son muy pequeñas.

Propiedades de las disoluciones
Las propiedades de una disolución son muy diferentes de las de las formas puras de sus componentes. Por ejemplo, solo el agua pura se congela o solidifica a 273 K y hierve a 373 K. El punto de congelación del agua del océano es más bajo.
Generalmente se realiza un estudio cuantitativo de las propiedades físicas de las soluciones en un curso de termodinámica, y aquí solo mencionamos algunas de las aplicaciones solo para aumentar su conocimiento de la disolución.
Las propiedades físicas de los compuestos, como el punto de fusión y el punto de ebullición, cambian cuando se agregan otros compuestos. Juntos se llaman propiedades coligativas. Hay varias formas de cuantificar la cantidad de un compuesto disuelto en los otros compuestos llamados colectivamente concentración. Los ejemplos incluyen molaridad, fracción de volumen y fracción molar.
Las propiedades de las disoluciones ideales se pueden calcular mediante la combinación lineal de las propiedades de sus componentes. Si tanto el soluto como el solvente existen en cantidades iguales, como en una disolución de 50% de etanol, 50% de agua, los conceptos de «soluto» y «solvente» se vuelven menos relevantes.
Proceso de disolución
Se forma una disolución cuando dos o más sustancias se combinan físicamente para producir una mezcla que es homogénea a nivel molecular. El solvente es el componente más concentrado y determina el estado físico de la disolución. Los solutos son los otros componentes típicamente presentes en concentraciones menores que la del solvente. Las soluciones pueden formarse endotérmicamente o exotérmicamente, dependiendo de las magnitudes relativas de las fuerzas de atracción intermoleculares de solutos y solventes.
Concentración de las disoluciones
La concentración de una disolución es la cantidad de soluto presente en una cantidad dada. En otras palabras, la concentración de una solución es la masa del soluto en gramos, que está presente en 100 g de una solución. Dependiendo de la cantidad de soluto presente, se llama una solución diluida, concentrada o saturada.
Diferentes sustancias en un solvente dado tienen diferentes solubilidades a la misma temperatura. El método más común para expresar la concentración de una solución es el método porcentual. La concentración de las disoluciones se refiere al porcentaje de soluto presente en las disoluciones.
Disolución concentrada
Una disolución concentrada contiene tanto soluto como puede contener. Los químicos a menudo prefieren llamar a tal solución saturada. Las diluciones se hacen agregando solvente a una solución más concentrada. Es una práctica común preparar una disolución relativamente concentrada, llamada solución madre, y usarla para preparar disoluciones más diluidas.
Disoluciones molares
La concentración molar, también llamada molaridad, es el número de moles de soluto por litro de disolución. La molaridad es la medida más común de la concentración de la solución. Debido a que las mediciones de molaridad son mediciones de moles, a menudo utilizamos esta unidad para cálculos estequiométricos.

Esto con la finalidad de determinar la cantidad de producto químico en una mezcla dada. No confunda los lunares con la molaridad. La molaridad es una medida de concentración, mientras que los lunares son una medida de la cantidad de sustancia.
El volumen en la definición de molaridad se refiere al volumen de la disolución y no al volumen del solvente. La razón de esto es porque un litro de solución generalmente contiene un poco más o un poco menos de 1 litro de solvente, debido a la presencia del soluto.
Disolución diluida
Se dice que una disolución que contiene pocas partículas de soluto está diluida. Para concentrar una solución, se deben agregar más partículas de soluto o se debe eliminar algún solvente. Si el disolvente no es volátil, se puede concentrar una solución por evaporación o ebullición del disolvente.
Disolución estioquiométrica
La estequiometría se ocupa de las cantidades relativas de reactivos y productos en reacciones químicas. Se puede usar para encontrar las cantidades de los productos de reactivos dados en una reacción química equilibrada, así como el porcentaje de rendimiento.
Para calcular la cantidad de un producto, calcule el número de moles para cada reactivo. Los lunares de un producto son iguales a los moles de un reactivo limitante en la estequiometría de reacción uno a uno. Para encontrar la masa del producto, los moles deben multiplicarse por el peso molecular del producto.

Preparación de las disoluciones
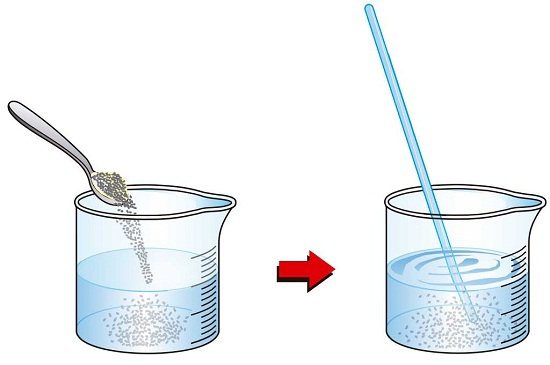
Una disolución simple es básicamente dos sustancias que se mezclan uniformemente. Uno de ellos se llama soluto y el otro es el solvente. Un soluto es la sustancia a disolver (azúcar). El solvente es el que hace la disolución (agua). Como regla general, generalmente hay más solvente que soluto. Sea paciente con la siguiente oración mientras la juntamos. La cantidad de soluto que puede disolver el solvente se define como solubilidad.
Disoluciones coloides y suspensiones
Las disoluciones, suspensiones, coloides y otras dispersiones son similares pero tienen características que diferencian a cada uno de los demás.
Solución
Una disolución es una mezcla homogénea de dos o más componentes. El agente de disolución es el solvente. La sustancia que se disuelve es el soluto. Los componentes de una disolución son átomos, iones o moléculas, lo que los hace de 10 a 9 mo menos de diámetro.
Ejemplo: azúcar y agua.
Suspensiones
Las partículas en suspensiones son más grandes que las que se encuentran en las disoluciones. Los componentes de una suspensión se pueden distribuir uniformemente por medios mecánicos, como sacudiendo el contenido, pero los componentes finalmente se asentarán.
Las suspensiones son heterogéneas, lo que significa que los componentes no se mezclan completamente y probablemente se separarán en un futuro cercano. Por otro lado, las disoluciones son homogéneas porque los componentes se mezclan completamente y permanecen mezclados sin separación.
Ejemplo: aceite y agua
Coloides
Las partículas de tamaño intermedio entre las que se encuentran en disoluciones y suspensiones pueden mezclarse de tal manera que permanezcan distribuidas uniformemente sin sedimentarse. Estas partículas varían en tamaño de 10 -8 a 10 -6 m de tamaño y se denominan partículas coloidales o coloides. La mezcla que forman se llama dispersión coloidal. Una dispersión coloidal consiste en coloides en un medio dispersante.
Ejemplo: leche
Puede distinguir suspensiones de coloides y disoluciones porque los componentes de las suspensiones eventualmente se separarán. Los coloides se pueden distinguir de las soluciones que usan el efecto Tyndall. Un haz de luz que pasa a través de una disolución verdadera, como el aire, no es visible. La luz que pasa a través de una dispersión coloidal, como el aire con humo o niebla, será reflejada por las partículas más grandes y el haz de luz será visible.
Disoluciones ideales
Una disolución ideal se define como aquella en la que las interacciones de las moléculas del disolvente entre sí son iguales a sus interacciones con los solutos. Las propiedades de una disolución ideal se pueden calcular mediante la combinación lineal de las propiedades de sus componentes.
Disoluciones solventes
Las disoluciones solventes pueden clasificarse ampliamente en solventes polares y no polares. Generalmente, los compuestos polares o iónicos se disolverán solo en disolventes polares, mientras que los solutos no polares se disolverán en disolventes no polares. La regla general es, «lo similar se disuelve como». La polaridad de un solvente se mide comúnmente en términos de su constante dieléctrica.
El agua, un solvente altamente polar, tiene una constante dieléctrica de 78.5. El etanol, con una constante dieléctrica de 24,3, tiene polaridad intermedia. Un ejemplo de un solvente no polar es el hexano, que tiene una constante dieléctrica de 1.9. Una prueba simple para la polaridad de un solvente líquido es frotar una varilla de plástico para inducir electricidad estática. Si esta varilla cargada se mantiene cerca de una corriente del solvente y la trayectoria del solvente se desvía, el solvente es polar.
Las moléculas de algunas sustancias, como el dodecil sulfato de sodio, tienen regiones polares y no polares. Esta clase de moléculas, llamadas moléculas anfipáticas, incluye tensioactivos, como jabones y emulsionantes. Las moléculas del tensioactivo pueden estabilizar las emulsiones al alinearse en la interfaz entre los líquidos polares y no polares, con sus extremos polares en el líquido polar y sus extremos no polares en el líquido no polar.
Solvatación
Dentro de una disolución, las moléculas o iones del soluto se rodean de moléculas solventes. Si las moléculas de disolvente forman estructuras relativamente estables alrededor de las moléculas de soluto, este proceso se conoce como solvatación. Por ejemplo, cuando la sal de mesa (cloruro de sodio) se disuelve en agua, las moléculas de agua polar rodean a cada uno de los iones de sodio (cationes) e iones de cloruro (aniones) para formar estructuras relativamente estables. Por lo tanto, la solvatación permite que la interacción soluto-solvente permanezca estable.
Solubilidad y saturación de las disoluciones
La capacidad de un compuesto para disolverse en otro compuesto se llama solubilidad. Cuando un líquido puede disolverse completamente en otro líquido, los dos líquidos son miscibles. Se dice que dos sustancias que nunca pueden mezclarse para formar una solución son inmiscibles
La cantidad de un soluto que se disolverá en una cantidad específica de solvente bajo condiciones dadas se llama solubilidad del soluto en ese solvente. Cuando no se puede disolver más de un soluto en un disolvente, se dice que la solución está saturada.
Sin embargo, el punto en el que una disolución puede saturarse depende significativamente de factores ambientales como la temperatura, la presión y la contaminación. Aumentar la solubilidad, por ejemplo, al aumentar la temperatura para disolver más soluto, y luego disminuir la solubilidad, hace que una solución se vuelva sobresaturada.

En general, cuanto mayor sea la temperatura de un solvente, más será el soluto sólido dado que se puede disolver. Sin embargo, algunos compuestos exhiben solubilidad inversa, lo que significa que a medida que el solvente se calienta, se puede disolver menos soluto.
Algunos tensioactivos exhiben este comportamiento. La solubilidad de los líquidos en líquidos es generalmente menos sensible a la temperatura que la de los sólidos o gases, mientras que los gases generalmente se vuelven menos solubles al aumentar la temperatura. A menos que dos sustancias sean completamente miscibles, existe una concentración a la que no se disolverá ningún soluto adicional en una solución.
En este punto, se dice que la solución está saturada. Si se agrega un soluto adicional a una disolución saturada, no se disolverá. En cambio, se producirá una separación de fases, lo que conducirá a fases coexistentes o una suspensión. El punto de saturación depende de muchas variables, como la temperatura ambiente y la naturaleza química precisa del solvente y el soluto.
Clasificación de las disoluciones
Las disoluciones se pueden clasificar en diferentes formas, en función de una serie de criterios, como la diferencia en el soluto o el disolvente, entre otros. Veamos las diferentes clasificaciones de las disoluciones, en función de diferentes criterios.
Sobre la base del agua como disolvente
Según si el disolvente es agua o no, las soluciones son de dos tipos.
Disoluciones acuosas
Estas disoluciones tienen agua como solvente. Ejemplos de tales soluciones son azúcar en agua, dióxido de carbono en agua, etc.
Disoluciones no acuosas
Estas disoluciones tienen un solvente que no es agua. Puede ser éter, benceno, gasolina, tetracloruro de carbono, etc. Los ejemplos comunes incluyen azufre en disulfuro de carbono, naftaleno en benceno, entre otros.
Sobre la base de la cantidad de soluto añadido
Según la cantidad de soluto presente en la disolución, podemos clasificarlos en los siguientes tipos.
Disolución no saturada
Una disolución no saturada es aquella que puede disolver más soluto a una temperatura definida. Significa que aún podemos agregar más soluto al solvente.
Disolución saturada
Se dice que una disolución está saturada cuando no podemos agregar más soluto al solvente. Esto significa que la solución no puede disolver más soluto a una temperatura definida.
Disolución supe saturada
Una disolución sobresaturada es aquella en la que el soluto está presente en una cantidad excesiva. Este soluto se disuelve con fuerza al elevar la temperatura o la presión de la disolución. Estos generalmente cristalizan en el fondo por el método llamado cristalización.
Sobre la base de la cantidad de solvente agregado
Disolución concentrada
Una disolución concentrada tiene grandes cantidades de soluto en el disolvente dado. Los ejemplos incluyen solución de salmuera, jugo de naranja, té de color oscuro.
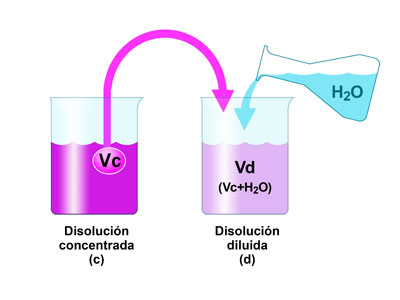
Disolución diluida
La disolución diluida tiene una pequeña cantidad de soluto en una gran cantidad de disolvente. Los ejemplos incluyen solución de sal, té de color claro.
Sobre la base de la concentración de soluto en dos soluciones
Consideremos una celda colocada en una disolución en un vaso de precipitados. En base a la concentración de soluto en dos solventes. En la celda y en el vaso de precipitados podemos tener los siguientes tipos de soluciones:
Disolución isotónica
Estas disoluciones tienen la misma concentración del soluto. Por lo tanto, el agua se mueve a través de la celda desde la solución en el vaso en ambas direcciones.
Disolución hipertónica
La disolución mantenida en el vaso de precipitados tiene una mayor concentración de soluto, por lo que el agua sale de la célula y entra en la solución en el vaso de precipitados, lo que hace que la célula se plasmolice / encoja.
Disolución hipotónica
La disolución que se mantiene en el vaso de precipitados tiene una concentración más baja de soluto, por lo que el agua se mueve hacia la célula haciendo que las células se hinchen y finalmente exploten.
Tipos de soluciones
A nivel molecular, las moléculas y los iones de un soluto se mezclan completamente e interactúan con los del solvente cuando un soluto se disuelve en un solvente. Este tipo de mezcla es homogéneo porque no hay límites visibles en toda la solución. En una mezcla, pueden existir diferencias entre regiones o partes de todo el sistema.
El material existe en tres estados: sólido, líquido y gaseoso. Existen soluciones en todos estos estados:
Disoluciones gaseosas
Si el solvente es un gas, solo los gases se disuelven bajo un conjunto dado de condiciones. Un ejemplo de solución gaseosa es el aire, que es oxígeno y otros gases disueltos en nitrógeno. Dado que las interacciones entre las moléculas no juegan casi ningún papel, los gases diluidos forman soluciones bastante triviales. En parte de la literatura, ni siquiera se clasifican como soluciones, sino que se abordan como mezclas.
Las mezclas gaseosas son generalmente homogéneas y todas las mezclas de gases son disoluciones gaseosas. La atmósfera es una solución gaseosa que consta de nitrógeno, oxígeno, argón, dióxido de carbono, agua, metano y algunos otros componentes menores, pero su contenido de agua y dióxido de carbono puede variar según la temperatura y el lugar.
Disoluciones liquidas
Cuando las moléculas de gas, sólido o líquido se dispersan y mezclan con las de líquido, los estados homogéneos se denominan disoluciones líquidas. Sólido, líquido y gaseoso se disuelve en líquido para formar soluciones líquidas. En general, los términos solución y solución líquida son sinónimos.
Los gases y las soluciones líquidas han atraído la atención de la mayoría de los químicos, mientras que los científicos e ingenieros de materiales están más interesados en la fabricación y las propiedades de las soluciones sólidas.
Si el solvente es un líquido, entonces casi todos los gases, líquidos y sólidos se pueden disolver. Aquí hay unos ejemplos:
Gas en líquido
- Oxígeno en agua
- Dióxido de carbono en agua. Un ejemplo menos simple, porque la solución se acompaña de una reacción química (formación de iones). Tenga en cuenta también que las burbujas visibles en el agua carbonatada no son el gas disuelto, sino solo una efervescencia de dióxido de carbono que ha salido de la solución; el gas disuelto en sí no es visible ya que se disuelve a nivel molecular.
Líquido en líquido
- La mezcla de dos o más sustancias de la misma química pero diferentes concentraciones para formar una constante.
- Las bebidas alcohólicas son básicamente disoluciones de etanol en agua.
Sólido en líquido
- Sacarosa en agua
- Cloruro de sodio o cualquier otra sal en agua, que forma un electrolito al disolverse, la sal se disocia en iones.
- Las soluciones en agua son especialmente comunes y se llaman disoluciones acuosas
Los fluidos corporales son ejemplos de disoluciones líquidas complejas que contienen muchos solutos. Muchos de estos son electrolitos, ya que contienen iones solutos, como el potasio. Además, contienen moléculas de soluto como azúcar y urea. El oxígeno y el dióxido de carbono también son componentes esenciales de la química de la sangre, donde los cambios significativos en sus concentraciones pueden ser un signo de enfermedad o lesión grave.

Disoluciones solidas
Muchas aleaciones, cerámicas y mezclas de polímeros son disoluciones sólidas. Dentro de un cierto rango, el cobre y el zinc se disuelven entre sí y se endurecen para dar disoluciones sólidas llamadas latón. La plata, el oro y el cobre forman muchas aleaciones diferentes con colores y aspectos únicos. Las aleaciones y las disoluciones sólidas son importantes en el mundo de los materiales.
Si el solvente es un sólido, entonces los gases, líquidos y sólidos pueden disolverse.
Gas en sólidos
- El hidrógeno se disuelve bastante bien en metales, especialmente en paladio. Esto se estudia como un medio de almacenamiento de hidrógeno.
Líquido en sólido
- Mercurio en oro, formando una amalgama.
- Agua en sal sólida o azúcar, formando sólidos húmedos.
- Hexano en cera de parafina.
Sólido en sólido
- Acero, básicamente una solución de átomos de carbono en una matriz cristalina de átomos de hierro.
- Aleaciones como bronce y muchas otras.
- Polímeros que contienen plastificantes
Otros tipos de disoluciones
Las disoluciones en biología también son comunes, por lo que resaltaremos algunas de las más importantes.
Disoluciones polares
Se crea una disolución polar cuando un solvente polar disuelve un soluto polar. Las cargas opuestas en las moléculas de disolvente interactúan con las cargas opuestas en las moléculas de soluto, que las distribuye por todo el disolvente. En una solución polar, los enlaces tienen carga estática, ya que no cambian. Este no es el caso de una solución no polar.
En una disolución no polar, el mismo principio de cargas opuestas que actúan entre sí hace que el disolvente disuelva el soluto. Sin embargo, las moléculas no polares no tienen cargas estáticas. En cambio, los electrones a veces se agrupan en el mismo lado de la molécula. Esta área negativa empuja los electrones en otras moléculas, y crea áreas positivas de carga.
Disoluciones acidas
En sistemas biológicos, la acidez de una disolución es importante. Si una solución es demasiado ácida o demasiado básica, las proteínas en una célula perderán su forma y no funcionarán correctamente. El agua es el solvente en la mayoría de los sistemas biológicos, y muchos químicos pueden cambiar la acidez del agua.
Las células tienen muchos mecanismos para mantener equilibrados los ácidos y las bases de sus células. Algunas células también pueden producir tampones o productos químicos que tienden a mantener una solución con una cierta acidez.
Ejemplo de disoluciones
Cualquier sustancia disuelta en otra sustancia se considera una disolución. El solvente, material que se disuelve, en la mayoría de las sustancias domésticas es el agua. Entonces, cualquier cosa disuelta en agua sería una solución. La sustancia disuelta se llama soluto. Puede diluir una disolución agregando más solvente o quitando solutos. Puede concentrarlo agregando más solutos o quitando el solvente.
Algunos cartones de jugo dirán «jugo de concentrado» en la lista de ingredientes. El jugo se concentró primero evaporando el agua, eliminando el disolvente, y luego se diluyó agregando agua.
Algunos ejemplos de disoluciones en la vida cotidiana serían:
- Café o té
- Té dulce o café (azúcar agregado a la solución)
- Cualquier jugo
- Agua salada
- Lejía (hipoclorito de sodio disuelto en agua)
- Agua para lavar platos (jabón disuelto en agua)
- Bebidas carbonatadas (el dióxido de carbono disuelto en agua es lo que le da a las gaseosas su efervescencia)
- Bebidas en polvo
- El agua salada es una solución porque el soluto, la sal, se disuelve en el solvente, el agua. El proceso de disolución de la sal también podría llamarse solución
- Si coloca bicarbonato de sodio en vinagre obtiene acetato de sodio y dióxido de carbono. El acetato de sodio se usa como saborizante. Si la mezcla se mantiene en un recipiente sellado que puede contener la presión, el dióxido de carbono permanecerá en disolución.

Ejemplos disoluciones molares, ácidas y básicas
Nutrientes en el suelo
Las plantas necesitan acceso a nutrientes y minerales en el suelo para sobrevivir. Para obtener estos nutrientes y minerales, las plantas deben difundir los nutrientes a través de las membranas de sus raíces. Para hacer esto, los nutrientes deben ser disueltos por el agua. La disolución baña las raíces y las proteínas incrustadas en las membranas de la raíz pueden transportar el nutriente a las células. Una vez que las células tienen los nutrientes, más agua inunda las células.
Este mecanismo en las plantas permite que el agua y los nutrientes fluyan desde las raíces hasta las hojas superiores, incluso en los árboles más altos. En las hojas, la planta transpira el agua en el aire, permitiendo que la presión osmótica continúe forzando nutrientes y riegue las hojas. Todo esto es posible porque el agua es una excelente disolución que crea las soluciones necesarias para la vida.
Néctar de flores
Muchas flores producen una disolución en sus flores que atraen abejas, pájaros y otros polinizadores. La disolución utiliza un solvente de agua y un soluto de azúcar. El agua es un solvente polar y el azúcar es un soluto polar. Juntos, hacen una disolución polar. Esta disolución de agua azucarada proporciona una fuente de nutrición fácilmente digerible para los polinizadores. Las abejas usan la disolución para crear miel, otra solución más viscosa que se usa para alimentar a sus crías.
Los colibríes y algunos otros polinizadores simplemente usan la disolución para obtener energía. Aunque no parezca mucho, los enlaces de azúcar contienen una enorme cantidad de energía. De hecho, incluso el cuerpo humano depende de la glucosa para obtener energía. La mayor parte del azúcar que comemos proviene de frutas y verduras, y está en una forma más compleja que nuestro cuerpo debe descomponer.
Disoluciones Coloidales
Las propiedades de una disolución que dependen solo de la concentración de partículas de soluto se denominan propiedades coligativas. Incluyen cambios en la presión de vapor, el punto de ebullición y el punto de congelación del solvente en la solución. Las magnitudes de estas propiedades dependen solo de la concentración total de partículas de soluto en disolución, no del tipo de partículas. La concentración total de partículas de soluto en una disolución también determina su presión osmótica.

Disoluciones Isotónicas
Las sustancias que se disuelven en agua para producir iones se llaman electrolitos. Los electrolitos pueden ser compuestos covalentes que reaccionan químicamente con agua para producir iones. Por ejemplo, ácidos y bases. O pueden ser compuestos iónicos que se disocian para producir sus cationes y aniones constituyentes, cuando se disuelven. La disolución de un compuesto iónico se ve facilitada por las atracciones de dipolo iónico entre los iones del compuesto y las moléculas de agua polar.
Coloides
Los coloides son mezclas en las que una o más sustancias se dispersan como partículas sólidas relativamente grandes o gotas líquidas en un medio sólido, líquido o gaseoso. Las partículas de un coloide permanecen dispersas y no se depositan debido a la gravedad, y a menudo están cargadas eléctricamente. Los coloides son de naturaleza generalizada y están involucrados en muchas aplicaciones tecnológicas.

Diferencia entre disolución, coloides y suspensión
La disolución es la mezcla homogénea, mientras que la disolución coloidal y la suspensión son las mezclas heterogéneas de dos o más sustancias. Otra diferencia entre estos tres tipos es que la disolución es transparente, mientras que la disolución coloidal es translúcida y la suspensión es opaca.